오늘은 종종 질문이 있는 제조지원설비의 재적격성평가 주기에 대해 관련 가이드라인 내용을 정리하고자 합니다.
제조지원설비의 분류에는
1. 제조용수 시스템(정제수, 주사용수, 청정증기)
2. 공기조화시스템
3. 가스 시스템(압축공기, 질소가스 등)
3가지로 분류할 수 있습니다.
제조지원설비의 경우 정기적 환경모니터링을 실시하기 때문에 재적격성평가를 생략하는 경우도 있지만, 가이드라인에서는 정기적으로 평가 해야 한다고 명시하고 있습니다. 따라서 적절한 주기를 설정하여 관리하는 것이 필요합니다.
| 의약품 제조 및 품질관리에 관한 규정 [별표13] 적격성평가와 밸리데이션 |
| 8. 재밸리데이션 세척을 포함한 시설, 시스템, 설비 및 공정이 유효한 상태를 유지하고 있는지 확인하기 위하여 주기적으로 평가하여야 한다. 검증된 상태에 대하여 유의한 변경이 없었던 경우, 시설, 시스템, 설비 및 공정이 규정된 요건에 부합한다는 증거에 대한 검토로 재밸리데이션을 갈음한다. |
| 의약품 제조 및 품질관리에 관한 규정 [별표1] 무균의약품 제조 |
| 4. 청정작업실과 청정공기장치 모니터링 가. 청정작업실과 청정공기장치는 정기적으로 모니터링 하여야 하며, 모니터링 위치는 청정작업실 및 청정공기장치 또는 각각의 등급 분류 중에 얻은 결과와 공식적인 위험 분석 조사 결과에 근거하여야 한다. |
> 시설 역시 상태에 대해 주기적으로 평가해야 하지만, 변경이 없었던 경우 의약품 제조 및 품질관리에 관한 규정에서는 '검토'로 재밸리데이션을 갈음 할 수 있어 정기적 환경모니터링 결과에 대한 검토로 갈음이 가능하다고 생각됨.
| 완제의약품 제조 및 품질관리기준 가이던스, 제2개정판 추보(2018), 식품의약품안전처 |
| P.63 [해설] 마) 최근 PIC/S 가이드에서는 적격성평가가 완료된 장비, 시설, 설비 및 시스템이 제어된 상태에 있는지 확인하기 위해 적절한 주기로 재평가를 실시하도록 하고 있다. 재적격성평가의 주기는 위험평가에 기반하여 문서화되고 승인되어야 한다. |
| PIC/S GMP Annex 15, 3. Qualification Stage for Equipment, Facilities, Utilities ans Systems. |
| 4. RE-QUALIFICATION 재적격성평가 4.1 Equipment, Facilities, utilities and systems should be evaluated an appropriate frequency to confirm that they remain in a state of control. 장비, 시설, 설비 및 시스템은 적절한 빈도로 평가되어 제어된 상태에 있는지 확인해야 한다. 4.2 Where re-qualification is necessary and performed at a specific time period, the period should be justified and the criteria for evaluation defined. Furthermore, the possibility of small changes over time should be assessed. 재적격성평가가 특정 기간의 경과에 의하여 필요하고 수행되는 경우에, 해당 기간은 타당성이 부여되어야 하고 평가기준이 정의되어야 한다. 또한 시간의 경과에 따른 작은 변동 가능성도 평가되어야 한다. |
> 정기적으로 변동 가능성에 대해 평가하고 점검해야 한다고 하고 있음.
> 정기적 재적격성평가가 필요한 이유, 그치만 환경모니터링을 통해 영향평가가 잘 되고 있다면 대체가 가능하다고 생각함.
| WHO Tehnical Report Series, No.961, 2011 Annex 5 Supplementary guidelines on good manufacturing practices for heating, ventilation and airconditioning systems for non-sterile pharmaceutical dosage forms. |
| 8.2 Qualification 8.2.14 The maximum time interval between tests should be defined by the manufacturer. The type of facility under test and the product level of protection should be considered. Table 3 gives various tests that can be carried out. The required tests and intervals between testing should be determined through risk assessment. 각 시험항목의 최대 평가주기는 생산자가 설정해야 한다. 평가 대상 시설의 종류와 제품의 보호 수준을 고려한다. 표3에서는 수행되어야 하는 시험들을 언급하였다. 요구되는 시험항목들과 시험 주기는 위험평가를 바탕으로 결정해야 한다. 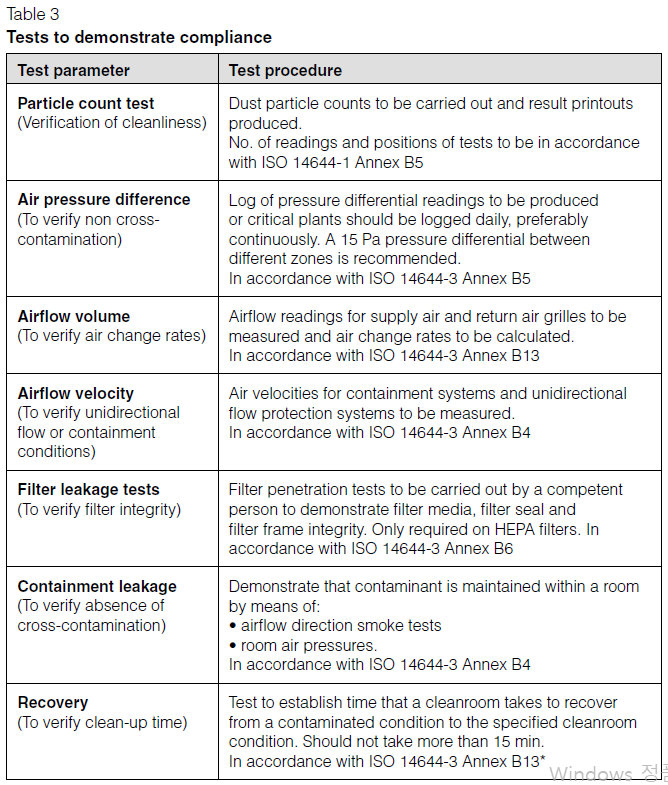  |
> WHO TRS에서는 주기적인 공기조화시스템의 재평가를 권고함. 그러나 본 가이드라인은 참고용으로 법적으로 요구되는 사항은 아님.
| WHO Expert Committee on Specifications for Pharmaceutical Preparations Annex 2 WHO good manufacturing practices: water for pharmaceutical use |
| 7.3 Continuous system monitoring 지속적인 시스템 모니터링 7.3.1 After completion of phase 3 of the qualification programme for the WPU system, a system review should be undertaken. Following this review a routine monitoring plan should be established based on the results of phase 3. 제약 용수에 대한 phase 3까지의 적격성평가가 종료된 후, 시스템 검토가 이루어져야 합니다. phase 3의 결과에 따라 정기적인 모니터링 방향을 수립해야 한다. |
> 제약용수 시스템의 경우에는 정기적모니터링에 대해 상세히(phase 1~3까지의 세부 내용) 기재하고 있으며, 정기적 모니터링 결과로 재적격성평가를 충분히 대체할 수 있다고 생각함.
| EudraLex Volume 4 EU Guidelines to GMP Medicinal Products for Human and Veterinary Use Annex 1 Manufacture of Sterile Medicinal Products(2008 rev.) |
| Clean room and clean air device monitoring 8. Clean rooms and clean air devices should be routinely monitored in operation and the monitoring locations based on a formal risk analysis study and the results obtained during the classification of rooms and/or clean air devices. 청정실 및 청정 공기 장치는 공식적인 위험 분석 연구와 청정실 및/또는 청정 공기 장치의 분류(청정도 확인) 중에 얻은 결과를 기반으로 장비의 가동 및 모니터링 위치에서 정기적으로 모니터링해야 합니다. |
| EudraLex Volume 4 EU Guidelines to GMP Medicinal Products for Human and Veterinary Use Annex 1 Manufacture of Sterile Medicinal Products (2020 개정 검토본) |
4.34 The requalification of cleanrooms and clean air equipment should be carried out periodically following defined procedures. The requirement for requalification of cleanroom areas is as follows: 청정실 및 청정 공기 장비의 재적격성평가는 정의된 절차에 따라 주기적으로 수행해야 합니다. 클린룸 영역의 재적격성평가 요건은 다음과 같습니다. For Grade A & B areas, the maximum time interval for requalification is 6 months. For Grade C & D areas, the maximum time interval for requalification is 12 months. 청정도 A & B 지역에서 최장 재적격성평가 기간은 6개월입니다. 청정도 C & D 지역에서 최장 재적격성평가 기간은 12개월입니다. Appropriate requalification consisting of at least the above tests should also be carried out following completion of remedial action implemented to rectify an out-of-compliance equipment or facility condition or after changes to equipment, facility or processes. The significance of a change should be determined through the change management process. Examples of changes to be considered include but are not limited to the following: 적합하지 않은 장비 또는 시설 상태를 변경하기 위해 시정 조치가 완료된 후 또는 장비, 시설 또는 프로세스가 변경된 후에도 최소한 위의 테스트로 구성된 적절한 재적격성 평가를 수행해야 합니다. 변경의 중요성은 변경 관리 프로세스를 통해 결정되어야 합니다. 재적격성평가를 고려해야 할 변경 사항의 예는 다음과 같으며, 이에 한정되지는 않습니다. i. Change in the operational use of the cleanroom, or of the operational setting parameters of the HVAC system. ii. Interruption of air movement which affects the operation of the installation. iii. Special maintenance which affects the operation of the installation (e.g. change of final filters). 1. 클린룸 운전 조건 및 공기조화시스템의 운전 설정 인자의 변경 2. 설비의 작동에 영향을 미치는 공기의 이동 중단(간섭). 3. 설비의 운영에 영향을 미치는 중요한 유지보수(예: 최종 필터 교체). |
현재 운영중인 EU GMP annex 1.에서는 정기적으로 모니터링하라고만 언급되어 있으나,
도입예정(검토중)인 EU GMP annex 1.에서는 변경에 따른 클린룸 및 공기조화시스템의 재적격성평가, 정기적 재적격성평가에 대해 세부적으로 안내하고 있다. 재적격성평가 기간과 변경 시 평가해야 하는 시험항목을 구체적으로 안내하고 있으며 이것이 적용된 이후에는 부유입자, Filter Integrity Test(Terminal Filter), 풍량, 청정실 차압, 풍속 확인시험을 실시해야 하는 것으로 명확해졌다.
> 청정실 및 공기조화시스템에 대한 세부적인 지침이 제공된 것은 처음이며, 이것이 실행된다면 일상적인 모니터링 활동 외에 정기적인 환경평가가 진행되어야 할 필요가 있다.
> 환경모니터링에서 부유입자 평가를 실시하고 있으나, 'worst point'에 한해 평가를 진행하고 있다면, 정기적 재적격성평가를 통해 주기적인 worst point의 변경을 적용할 수 있을 것 같음.
| ISO 14644-1:2015 |
 |
ISO 14644-1 에서도 일반적으로 1년주기의 청정도 확인시험을 실시할것을 가장 먼저 언급하고 있다. 단, risk assessment를 기반으로 하라고 적혀있기 때문에, 각 청정실의 위험평가를 바탕으로, 주기를 굳이 1년으로 적용하지는 않아도 됨.


댓글