오늘은 업무하면서 질문이 던져진 공기조화시스템의 PQ를 '왜' in operation / operational / 공정중 상태에서 실시해야 하는가에 대한 근거 조항 및 관련내용을 찾아보고자 합니다.
저는 이게 왜 질문거리인가? 했는데 생각보다 공조를 많이 접할일이 없기에 헷갈려하시는 것 같습니다.
(다른 분들도 안부글이나 댓글 등으로 질문이나 의견 남겨주시면 글 작성에 참고하겠습니다.)
| 의약품 제조 및 품질관리에 관한 규정, 식품의약품안전처 [별표1] 무균의약품 제조 |
 |
| EU GMP Volume 4 Annex 1. Manufacture of Sterile Medicinal Products (2008 rev.) |
 |
미생물(부유균, 낙하균, 표면균)의 경우 가이드라인의 기준은 공정중(in operation)에 대한 기준만이 존재합니다.
따라서 at rest 기준이 없기 때문에, at rest에서 저 기준으로 미생물을 평가했다면 애초에 전제조건이 맞지 않습니다.
EU Annex 1 = PIC/S 가이드라인
국내 KGMP는 PIC/S 가이드라인을 따라가기 때문에 동일한 내용을 적용합니다. 측정은 in operation에서 실시하는 결과만이 적합합니다.
| FDA Guideline cGMP Sterile Drug Products Produced by Aseptic Processing — Current Good Manufacturing Practice(2004) |
 |
cGMP에서는 under dynamic conditions에서의 평가 기준만 나와있습니다.
dynamic condition 상태에 대해서는 with personnel present, equipment in plae, on operations ongoing이라고 설명하니다. 작업자가 있고, 장비가 있으며, 공정이 가동중인 상태로 'in operation/operationa;'상태와 동일합니다.
cGMP에서는 dynamic conditions(in-operations)와 static conditions(as-built)상태만 있고, at-rest 상태에 대한 언급이 없습니다. 따라서 EU GMP와 마찬가지로 at-rest 상태에서의 기준이 없기 때문에, 미생물에 대한 at-rest 상태에서의 평가는 무의미합니다.
자, 미생물과 부유입자가 그렇다면 공기조화시스템의 다른 PQ항목은 어떨까요?
이제 ISO 14644 내용을 보겠습니다.
| ISO 14644-2:2000 |
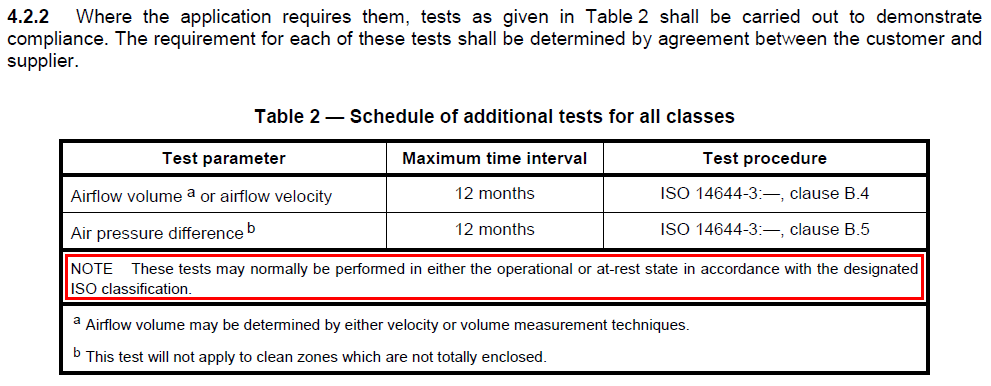 |
현재 ISO 14644-2의 최신버전은 2015년도 버전으로, 위 캡쳐본은 이전버전입니다.
신규 버전에는 해당 내용이 삭제되었음을 전달드립니다. 하지만 차압과 풍량, 풍속은 operational(in operation)이나 at-rest 상태에서든 상관 없이 실시할 수 있다고 작성되어 있습니다.
| ISO 14644-3:2019 |
  |
ISO 14644-3:2019에서도 성능평가는 as-built, at-rest, operational(in operation) 상태에서 가능하다고 합니다.
즉, ISO 14644-3에서 진행하는 대부분의 시험항목에 대해서는 3가지 occupancy state(operational, at-rest, as-built) 상태 모두에서 평가할 수 있습니다. (예외로 particle deposition test는 operational/in operation 상태에서 실시하라고 되어있습니다.)
단 이경우에도, 청정실에 위치한 장비가 시험항목의 결과에 영향을 주는 경우 장비가 가동중인 상태(최소한 at-rest)에서 평가하는 것이 적절하다고 생각합니다.
| 제조지원설비 등 밸리데이션 프로토콜, 식품의약품안전처(2009) |
  |
이 프로토콜은 의약품(케미컬)에서는 10년도 더 되었으나 여전히 유효합니다.
이 문서가 나왔던 2009년이랑 현재 KFDA의 청정도 관리기준에 대한 분류가 변경되었으며(당시 1A, 1B 급지 등으로 분류), 현재의 청정도에 적용한다면 1.1은 Unidirectional , Grade A~C / 1.2는 Non unidirectional Grade D 이하에 해당합니다.
즉 결론은, 의약품 제조소의 청정실의 성능적격성평가(부유입자, 부유균, 낙하균, 표면균)는 생산중인 상태에서 실시할 수 있으며, 최소한 시뮬레이션 상태에서 실시해야 합니다.
'제약 및 의료기기, GMP' 카테고리의 다른 글
| [업계 트렌드] 제약 업계는 지금 원료가 부족하다😥! (0) | 2023.09.26 |
|---|---|
| [업계 트렌드] 비만 치료제(위고비, 삭센다, 마운자로) 관련 기사 정리 (1) | 2023.09.25 |
| 2023년 한국의료기기공업협동조합 재직자 직무교육(2월) (0) | 2023.01.16 |
| 2023년 의료기기 RA 교육 정보 (한국 의료기기 안전정보원) (0) | 2022.12.29 |
| 200805 개념설계(Conceptual Design) 및 공기조화시스템(HVAC System) (0) | 2020.08.05 |
| 원료의약품 공정시험법과 기준항목 (0) | 2020.03.13 |


댓글